河南省腦靶向生物納米藥物重點實驗室圍繞國家“腦科學與類腦研究”重大科技項目研究方向�����,聚焦復雜腦部疾病的診療研究��。其中���,腦膠質瘤(GBM)是中樞神經系統最常見的腦腫瘤,其發生率和死亡率較高,臨床上至今仍缺乏安全、有效的治療方法�。GBM難以治愈主要歸因于腫瘤微環境復雜�、常見的單一治療方式效率低���、易產生耐藥性等��。針對該系列問題���,實驗室通過設計砷基納米藥物調控腫瘤微環境���、構建金屬螯合治療���、基因化動力聯合治療及CRISPR/Cas9基因編輯等新型治療策略���,實現了GBM的高效治療�。
腦膠質瘤的砷基納米藥物治療
針對還原及乏氧的腫瘤微環境��,實驗室設計了一種由銀納米粒子及表面螯合的砷V組成的砷基納米藥物���。其具有GSH應激釋放及內涵體逃逸特性�,能夠通過抑制腫瘤細胞內的GPx及SOD����,實現LC3自噬介導的細胞凋亡,進而有效抑制腫瘤細胞增殖。實驗結果表明�����,砷基納米藥物在腫瘤治療及原位檢測方面有著巨大的應用前景����。該成果發表在ACS Applied Materials & Interfaces 2022, 14, 32, 36487–36502(IF=10.383���,SCI一區期刊)����。博士研究生閆紀亮、博士后研究員Sumaira Hanif為該論文共同第一作者�,吳海剛博士����、Pir Muhammad博士為共同通訊作者�����。
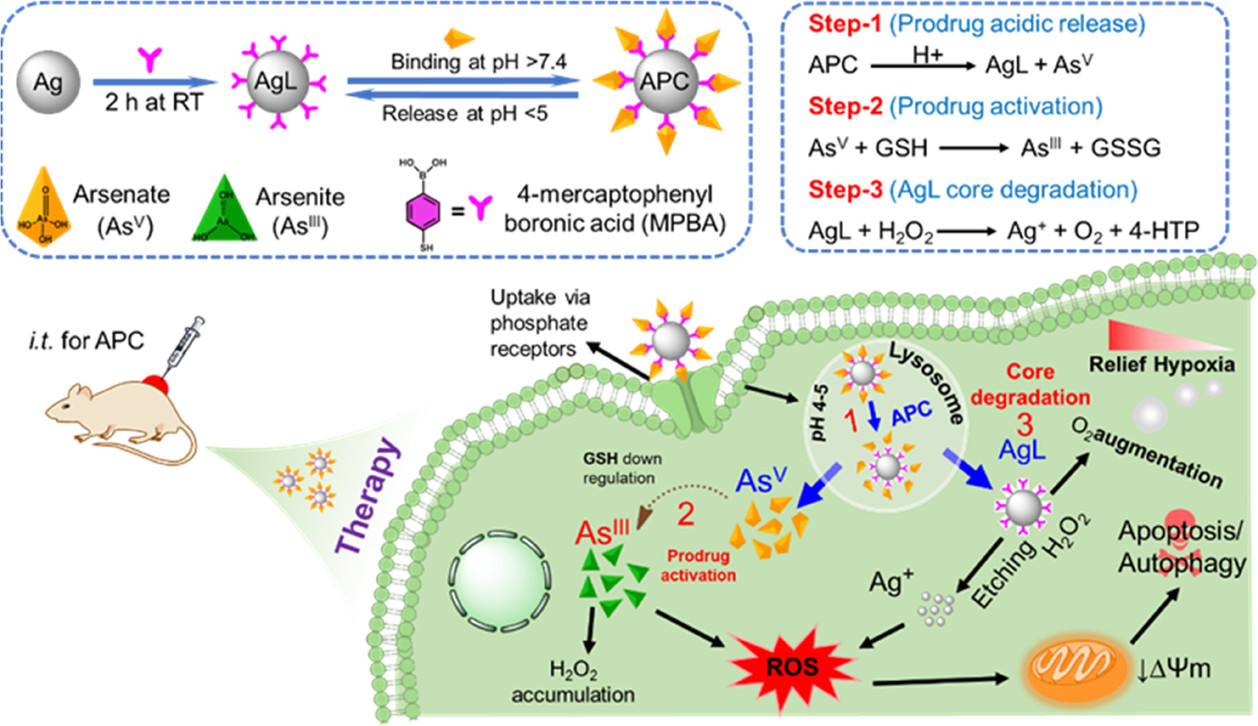
文章鏈接:https://doi.org/10.1021/acsami.2c12076
腦膠質瘤的金屬螯合治療
利用螯合劑2-(二-2-吡啶基亞甲基)-N,N-二甲基肼基硫代甲酰胺(Dp44mT)可選擇性靶向癌細胞中高濃度的銅離子并產生大量活性氧(ROS)來殺傷腫瘤細胞這一特點�,實驗室將Dp44mT與血管擴張劑瑞加德松(Reg)共同裝載到納米粒子中�����,外部修飾靶向多肽Angiopep-2功能化的紅細胞膜(Ang-M)����。實驗證明,該主動仿生納米藥物Ang-MNPs@(Dp44mT/Reg)可以有效穿越血腦屏障(BBB),主動靶向GBM病灶,且血液循環時間長,毒副作用低���。U87MG-luc原位GBM模型小鼠實驗表明,其能夠有效抑制腫瘤生長并延長荷瘤小鼠的生存周期。該納米遞送系統還可拓展為一體化平臺應用于腦部疾病的診療���。該成果發表在Biomaterials 2022, 289, 121760(IF=15.305,SCI一區期刊)。博士后研究員Muhammad Ismail、研究生楊汶��、李彥飛為該論文共同第一作者�����,冰洋教授、David B. Lovejoy教授為共同通訊作者�����。
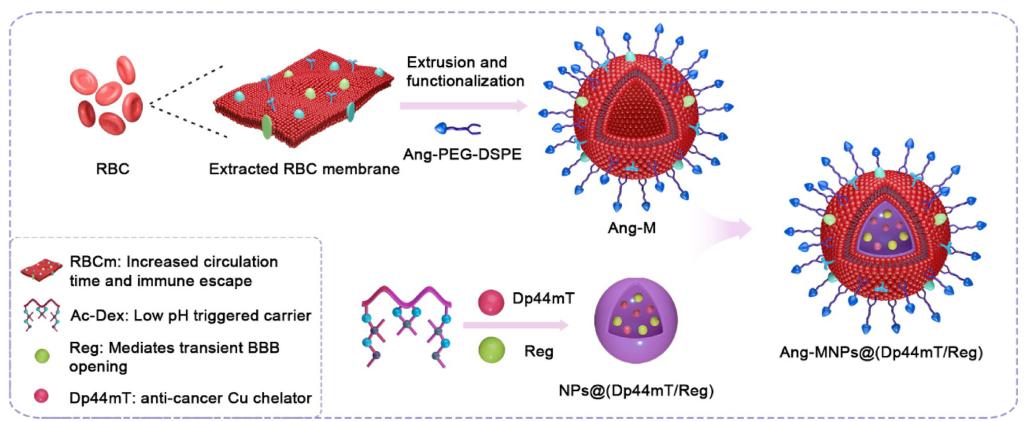
文章鏈接:https://doi.org/10.1016/j.biomaterials.2022.121760
腦膠質瘤的化學動力學和RNAi聯合治療
利用化學動力學療法(CDT)具有無侵襲性和高響應性這一特點����,實驗室開發了以轉移性黑色素瘤細胞膜為外殼、電荷轉化賴氨酸為中間層����、siRNA絡合的聚乙烯亞胺黃原酸酯(PEX)為內核的仿生納米藥物�。其可有效穿透BBB���,PEX螯合腫瘤細胞中豐富的銅離子�,不僅導致GSH的耗竭,而且生成能殺死腫瘤細胞的羥基自由基(·OH)��。同時�����,抗凋亡蛋白Bcl-2的基因沉默導致ROS水平的增加����,從而誘導GBM細胞凋亡級聯反應��。在皮下黑色素瘤和原位GBM腫瘤模型中均展現優異的治療效果及延長的生存周期���。該成果發表在Advanced Functional Materials 2022, 2209239(IF=19.925��,SCI一區期刊),博士研究生張東亞為第一作者��,冰洋教授���、鄭蒙教授和鄒艷副教授為共同通訊作者��。
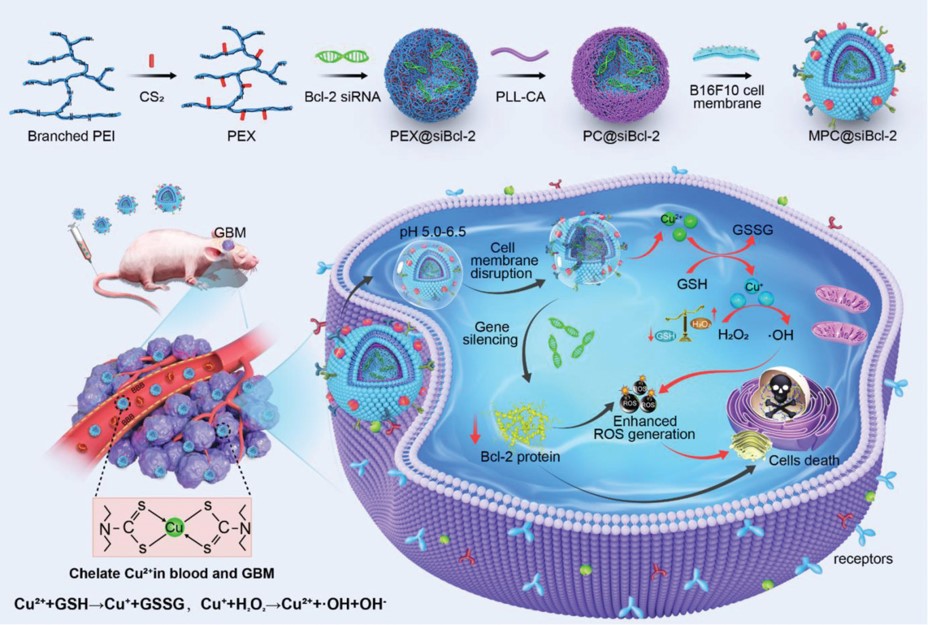
文章鏈接:https://doi.org/10.1002/adfm.202209239
腦膠質瘤的CRISPR/Cas9基因編輯治療
利用CRISPR基因編輯技術的特異性及高效性,實驗室開發了一種新型的聚合物載體,通過在聚合物上修飾胍基和含氟基團,能顯著提高對Cas9 RNP的包裹和裝載�。形成的納米顆?�?梢杂行Т┻^BBB、顯示出優越的血液循環時間、細胞內吞能力和藥物裝載能力���,同時,具備良好的生物相容性,能夠高效編輯致癌基因,從而抑制腫瘤生長�����,在臨床應用轉化上具有較好的前景�。該成果發表在Journal of Controlled Release 2022, 351, 739–751(IF=11.467,SCI一區期刊),阮衛民副教授和研究生焦明珠��、徐森為該論文共同第一作者����,冰洋教授、鄭蒙教授����、省人民醫院遷榮軍主任為共同通訊作者�。

文章鏈接:https://doi.org/10.1016/j.jconrel.2022.09.046
實驗室網址:https://bs.henu.edu.cn/cn.htm

